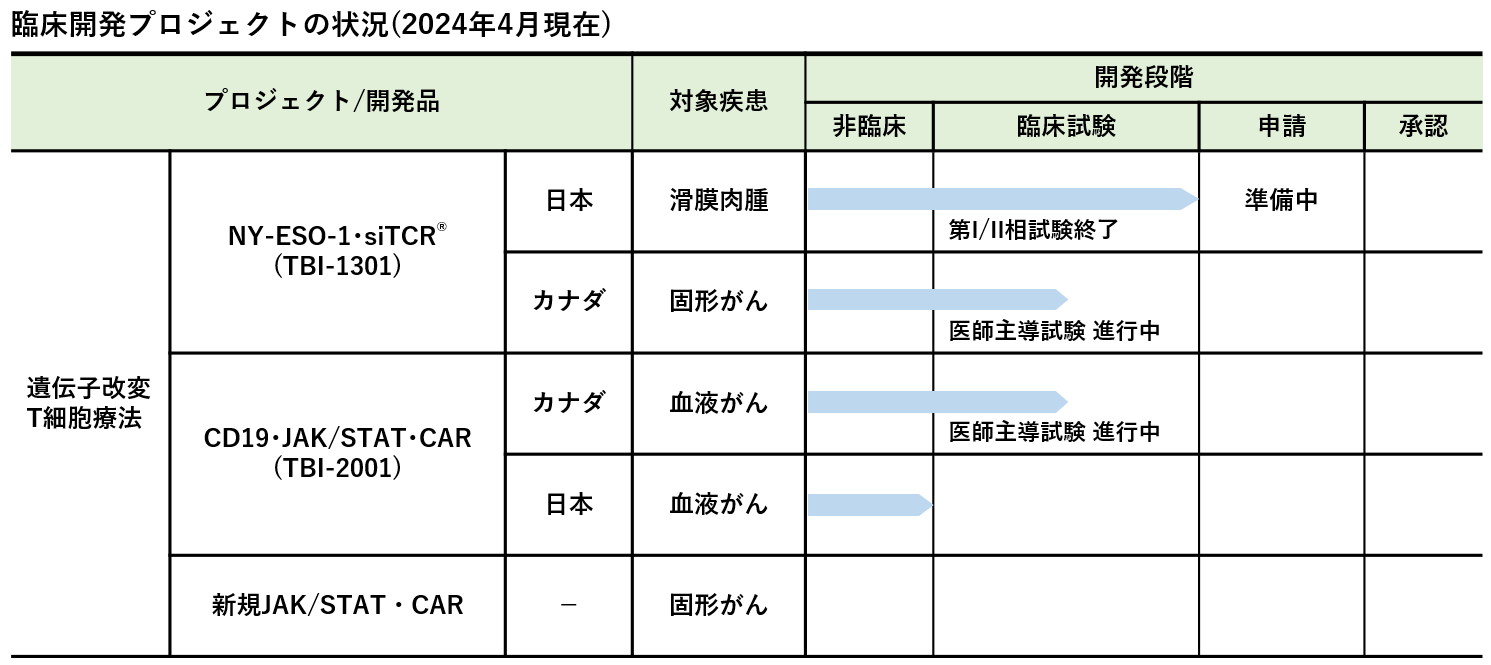
(注)表に掲載したプロジェクト以外にも医師主導治験、臨床研究を進めています。
- 「化学療法剤投与による前処置後のNY-ESO-1抗原特異的TCR遺伝子導入Tリンパ球輸注による滑膜肉腫を対象とした多施設共同第I/II相治験」(実施施設:国立病院機構大阪医療センター、三重大学、札幌医科大学等);jRCT1080223459, NCT03250325
- 「化学療法剤投与による前処置後のNY-ESO-1 抗原特異的TCR遺伝子導入T リンパ球輸注による固形癌を対象とした多施設共同臨床第Ⅰ相医師主導治験」(実施施設:三重大学・愛知医科大学・慶應義塾大学・国立がん研究センター東病院・国立がん研究センター中央病院・国立病院機構名古屋医療センター);jRCT2080222844 , NCT02366546
- 「Phase Ib Study of TBI-1301 (NY-ESO-1 Specific TCR Gene Transduced Autologous T Lymphocytes) in Patients with Solid Tumors」医師主導治験(実施施設:カナダ Princess Margaret Cancer Centre);NCT02869217
- 「Phase I/Ib Study of TBI-2001 for Patients With Relapsed or Refractory CD19+ B-cell Lymphoma, Chronic Lymphocytic Leukemia (CLL), Small Lymphocytic Lymphoma (SLL)」 医師主導治験(実施施設:カナダ Princess Margaret Cancer Centre);NCT05963217
腫瘍溶解性ウイルス C-REV(TBI-1401)
- 「根治切除不能又は転移性悪性黒色腫患者(ステージIIIB、IIIC及びIV)を対象としたTBI-1401(HF10)とイピリムマブとの併用療法の第II相試験」(実施施設:国立がん研究センター中央病院等); jRCT1080223536, NCT03153085
- 「A Phase II Study of Combination Treatment with HF10, a Replication-competent HSV-1 Oncolytic Virus, and Ipilimumab in Patients with Stage IIIB, Stage IIIC, or Stage IV Unresectable or Metastatic Melanoma」(実施施設:ハンツマン癌研究所等);NCT02272855
- 「Phase II Neoadjuvant trial of Nivolumab in Combination with HF10 Oncolytic Viral Therapy in Resectable Stage IIIB, IIIC, IVM1a Melanoma (Neo-NivoHF10)」医師主導治験(実施施設:ハンツマン癌研究所);NCT03259425)
- 「治癒切除不能な膵癌患者を対象としたTBI-1401(HF10)の化学療法併用第I相試験」(実施施設:神奈川県立がんセンター等);2017年9月より実施中、被験者募集終了(: jRCT1080223615, NCT03252808)
CD19・CAR遺伝子治療 (TBI-1501)
- 「再発又は難治性のCD19陽性B細胞性急性リンパ芽球性白血病患者を対象としたTBI-1501の多施設共同第I/II相臨床試験」(実施施設:自治医科大学、東京大学医科学研究所、三重大学等); jRCT1080223510, NCT03155191
各臨床試験に対するお問い合わせは下記メールアドレスまでお願いします。
メールアドレス:takara-clinical@takara-bio.co.jp
