タカラバイオ株式会社は、NY-ESO-1・siTCR®遺伝子治療(TBI-1301; mipetresgene autoleucel、以下「本品」)について、条件及び期限付き承認制度の活用も視野に入れ承認申請を目指してまいりましたが、医薬品医療機器総合機構(PMDA)との協議を踏まえ、新たに検証的試験を実施した上で本承認取得を目指す計画に変更します。
本品は、厚生労働省により「希少疾病用再生医療等製品」に指定されるとともに、「先駆け審査指定制度」の対象品目でもあるため、治験終了後は先駆け総合評価相談による優先的な審査を活用して承認申請を行います。検証的試験の治験計画届を速やかに提出し、新たに検証的試験を実施することにより、条件及び期限付き承認を取得する場合に比べて上市の時期は遅れるものの、本承認取得の時期は早まり、その確度も高まると考えています。
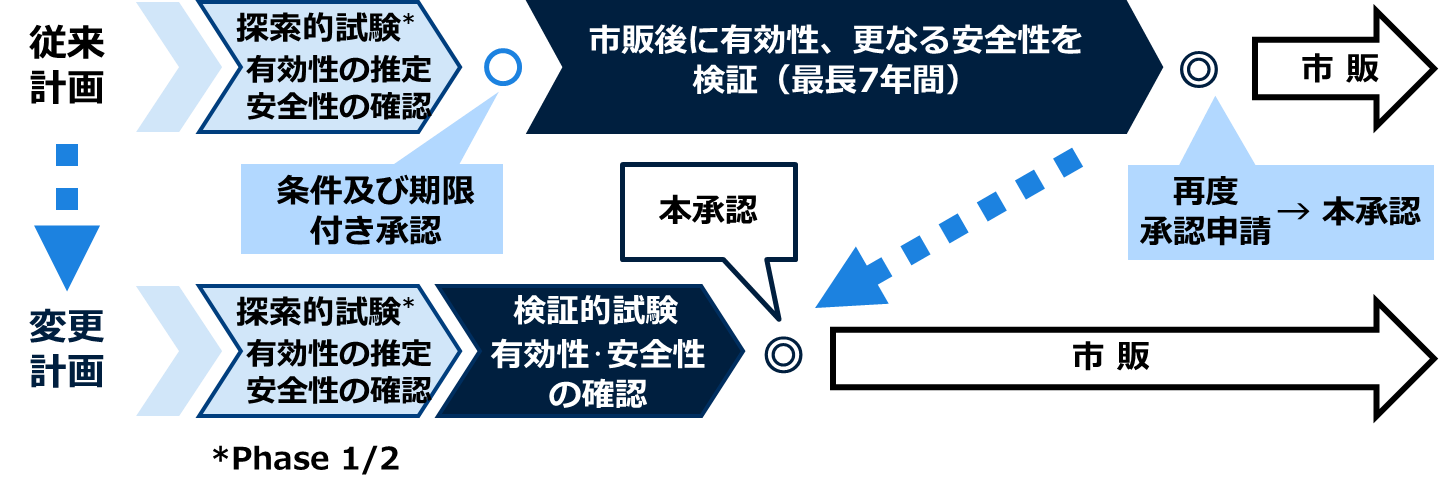
再生医療等製品の条件及び期限付き承認制度は、探索的臨床試験の結果から有効性が推定され、安全性が確認された再生医療等製品について、条件及び期限を付して早期に製造販売承認を受けることができる制度です。条件及び期限付き承認を取得した場合、市販後に有効性の検証及び安全性のさらなる評価を行い、期限内に本承認を得るための再申請を行うことが求められます。市販後の評価期間は、最長7年間とされており、一般的には治験と同様の管理を行うことが難しく、有効性の検証が難しくなるケースがあり、本制度の適用対象となる再生医療等製品の開発における留意事項等を示した「再生医療等製品に係る条件及び期限付承認並びにその後の有効性評価計画策定に関するガイダンスについて」(医薬機審発0329第3号、令和6年3月29日)が厚生労働省より発出されています。
このような状況を踏まえ、当社としては本承認を取得することにより、本品を将来にわたって持続的にお届けすることが、「滑膜肉腫」という難治性かつ治療の選択肢の少ない希少がんに対する新たな治療法を提供する上では重要であると判断しました。当社は、革新的な遺伝子・細胞加工の技術開発に注力し、開発した技術を幅広く提供することで、人々の健康に貢献してまいります。なお、本計画変更による今期の当社業績への影響は軽微です。
以上
この件に関するお問い合わせ先 : タカラバイオ株式会社 広報・IR部
Tel 077-565-6970
当資料取り扱い上の注意点
資料中の当社による現在の計画、見通し、戦略、確信などのうち、歴史的事実でないものは、将来の業績に関する見通しであり、これらは現時点において入手可能な情報から得られた当社経営陣の判断に基づくものですが、重大なリスクや不確実性を含んでいる情報から得られた多くの仮定および考えに基づきなされたものであります。実際の業績は、さまざまな要素によりこれら予測とは大きく異なる結果となり得ることをご承知おきください。実際の業績に影響を与える要素には、経済情勢、特に消費動向、為替レートの変動、法律・行政制度の変化、競合会社の価格・製品戦略による圧力、当社の既存製品および新製品の販売力の低下、生産中断、当社の知的所有権に対する侵害、急速な技術革新、重大な訴訟における不利な判決などがありますが、業績に影響を与える要素はこれらに限定されるものではありません。
